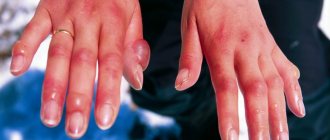
Таллий – это металл серебристо-белого цвета с голубым отливом. Распознать его на вкус и запах невозможно. Но и вряд ли кто-то рискнет пробовать это вещество. Ведь таллий – это яд, причем высокого уровня токсичности сродни свинцу и мышьяку. Отравление большими дозами нередко заканчивается летальным исходом. При постепенном воздействии на организм имеет свойство накапливаться в почках, легких, печени и головном мозге. Приводит к необратимым изменениям в работе органов и систем, крайне тяжело подается выведению.
Отравление таллием: признаки и последствия
в земной коре (кларк) 4,5 ? 10 -5 % по массе, но благодаря крайнему рассеянию его роль в природных процессах невелика. В природе встречаются преимущественно соединения одновалентного и реже трёхвалентного Т. Как и щелочные металлы, Т. концентрируется в верхней части земной коры — в гранитном слое (среднее содержание 1,5 ?
10 –4 %), в основных породах его меньше (2 ? 10 –5 %), а в ультраосновных лишь 1 ? 10 –6 %. Известно лишь семь минералов Т. (например, круксит, лорандит, врбаит и др.), все они крайне редкие. Наибольшее геохимическое сходство Т. имеет с К, rb, cs, а также с pb, ag, cu, bi. Т. легко мигрирует в биосфере. Из природных вод он сорбируется углями, глинами, гидроокислами марганца, накапливается при испарении воды (например, в озере Сиваш до 5 ?
Физические и химические свойства. Т. мягкий металл, на воздухе легко окисляется и быстро тускнеет. Т. при давлении 0,1 Мн/м 2 (1 кгс/см 2 ) и температуре ниже 233 °С имеет гексагональную плотноупакованную решётку ( а = 3,4496 å; с = 5,5137 å), выше 233 °С — объёмноцентрированную кубическую ( а = 4,841 å), при высоких давлениях 3,9 Гн/м 2 (39000 кгс/см 2 ) — гранецентрированную кубическую; плотность 11,85 г / см 3 ; атомный радиус 1,71 å, ионные радиусы: tl + 1,49 å, tl 3+ 1,05 å; t пл 303,6 °С; t кип 1457 °С, удельная теплоёмкость 0,130 кджl ( кг ?
k ) [0,031 кал/г ? С) > при 20—100 °С; температурный коэффициент линейного расширения 28 ? 10 –6 при 20 °С и 41,5 ? 10 –6 при 240—280 °С; теплопроводность 38,94 вт/ ( м ?
К ) [0,093 кал/ ( см ? сек ? °С)]. Удельное электросопротивление при 0°С (18 ? 10 –6 ом ? см ); температурный коэффициент электросопротивления 5,177 ? 10 –3 — 3,98 ?
10 –3 (0—100 °С). Температура перехода в сверхпроводящее состояние 2,39 К. Т. диамагнитен, его удельная магнитная восприимчивость —0,249 ? 10 –6 (30 °С).
Конфигурация внешней электронной оболочки атома tl 6 s 2 6 p 1 ; в соединениях имеет степень окисления +1 и + 3 . Т. взаимодействует с кислородом и галогенами уже при комнатной температуре, с серой и фосфором при нагревании. Хорошо растворяется в азотной, хуже в серной кислотах, не растворяется в галогенводородных, муравьиной, щавелевой и уксусной кислотах.
Не взаимодействует с растворами щелочей; свежеперегнанная вода, не содержащая кислорода, не действует на Т. Основные соединения с кислородом: закись tl 2 o и окись tl 2 o 3 .
Закись Т. и соли tl (i) нитрат, сульфат, карбонат — растворимы; хромат, бихромат, галогениды (за исключением фторида), а также окись Т. — малорастворимы в воде. tl (iii) образует большое число комплексных соединений с неорганическими и органическими лигандами.
Галогениды tl (iii) хорошо растворимы в воде. Наибольшее практическое значение имеют соединения tl (i).
Получение. В промышленных масштабах технический Т.
получают попутно при переработке сульфидных руд цветных металлов и железа. Его извлекают из полупродуктов свинцового, цинкового и медного производств. Выбор способа переработки сырья зависит от его состава.
Например, для извлечения Т. и др. ценных компонентов из пылей свинцового производства проводится сульфатизация материала в кипящем слое при 300—350 °С. Полученную сульфатную массу выщелачивают водой, и из раствора экстрагируют Т. 50%-ным раствором трибутилфосфата в керосине, содержащим йод, а затем реэкстрагируют серной кислотой (300 г/л ) с добавкой 3%-ной перекиси водорода.
Из реэкстрактов металл выделяют цементацией на цинковых листах. После переплавки под слоем едкого натра получают Т. чистотой 99,99%.
Для более глубокой очистки металла применяют электролитические рафинирование и кристаллизационную очистку.
Применение. В технике Т. применяется, главным образом, в виде соединений. Монокристаллы твёрдых растворов галогенидов tibr — tli и tlcl — tlbr (известные в технике как КРС-5 и КРС-6) используют для изготовления оптических деталей в приборах инфракрасной техники; кристаллы tlcl и tlcl—tlbr — в качестве радиаторов счётчиков Черенкова.
tl 2 o входит в состав некоторых оптических стекол; сульфиды, оксисульфиды, селениды, теллуриды — компоненты полупроводниковых материалов, использующихся при изготовлении фотосопротивлений, полупроводниковых выпрямителей, видиконов. Водный раствор смеси муравьино- и малоновокислого Т. (тяжёлая жидкость Клеричи) широко применяют для разделения минералов по плотности. Амальгама Т., затвердевающая при –59 °С, применяется в низкотемпературных термометрах. Металлический Т. используют для получения подшипниковых и легкоплавких сплавов, а также в кислородомерах для определения кислорода в воде.
204tl в качестве источника b -излучении применяют в радиоизотопных приборах.
Таллий в организме. Т. постоянно присутствует в тканях растений и животных. В почвах его среднее содержание составляет 10 –5 %, в морской воде 10 –9 %, в организмах животных 4 ? 10 –5 %. У млекопитающих Т. хорошо всасывается из желудочно-кишечного тракта, накапливаясь главным образом в селезёнке и мышцах.
У человека ежесуточное поступление Т. с продуктами питания и водой составляет около 1,6 мкг, с воздухом — 0,05 мкг. Биологическая роль Т. в организме не выяснена. Умеренно токсичен для растений и высоко токсичен для млекопитающих и человека.
Отравления Т. и его соединениями возможны при их получении и практическом использовании. Т. проникает в организм через органы дыхания, неповрежденную кожу и пищеварительный тракт.
Выводится из организма в течение длительного времени, преимущественно с мочой и калом. Острые, подострые и хронические отравления имеют сходную клиническую картину, различаясь выраженностью и быстротой возникновения симптомов. В острых случаях через 1—2 сут появляются признаки поражения желудочно-кишечного тракта (тошнота, рвота, боли в животе, понос, запор) и дыхательных путей. Через 2—3 нед наблюдаются выпадение волос, явления авитаминоза (сглаживание слизистой оболочки языка, трещины в углах рта и т.
д.). В тяжёлых случаях могут развиться полиневриты, психические расстройства, поражения зрения и др. Профилактика профессиональных отравлений: механизация производственных процессов, герметизация оборудования, вентиляция, использование средств индивидуальной защиты.
Лит.: Химия и технология редких и рассеянных элементов, под ред. К. А. Большакова, т. 1, [М., 1965]; 3еликман А. Н., Меерсон Г. А., Металлургия редких металлов, М., 1973; Таллий и его применение в современной технике, М., 1968; Тихова Г.
С., Дарвойд Т. И., Рекомендации по промышленной санитарии и технике безопасности при работе с таллием и его соединениями, в сборнике: Редкие металлы, в. 2, М., 1964; Воwen Н. y. М., trace elements in biochemistry, l.—n. y., 1966.
Израэльсон З. И., Могилевская О. Я., Суворове. В. Вопросы гигиены труда и профессиональной патологии при работе с редкими металлами, М., 1973.
Профилактика
Отравления таллием чаще всего наблюдаются у сотрудников производств, в технологическом процессе которых используется этот металл или его соединения. Поэтому для их профилактики необходимо наладить тщательный контроль соблюдения работниками правил техники безопасности.
При работах на опасном участке необходимо использовать средства индивидуальной защиты (респираторы, перчатки, специальную обувь и робу). После окончания смены сотрудники должны снять рабочую одежду и сдать ее в прачечную, обязательно принять душ.
Для профилактики отравления таллием нельзя на рабочем месте курить, пить воду или принимать пищу.
Все сотрудники, контактирующие с таллием, должны регулярно проходить медицинские осмотры. В случае выявления признаков отравления они подлежат немедленной госпитализации, в дальнейшем работать на вредном участке им запрещено.
Образование: окончила Ташкентский государственный медицинский институт по специальности лечебное дело в 1991 году. Неоднократно проходила курсы повышения квалификации.
Опыт работы: врач анестезиолог-реаниматолог городского родильного комплекса, врач реаниматолог отделения гемодиализа.
Информация является обобщенной и предоставляется в ознакомительных целях. При первых признаках болезни обратитесь к врачу. Самолечение опасно для здоровья!
Стоматологи появились относительно недавно. Еще в 19 веке вырывать больные зубы входило в обязанности обычного парикмахера.
На лекарства от аллергии только в США тратится более 500 млн долларов в год. Вы все еще верите в то, что способ окончательно победить аллергию будет найден?
Упав с осла, вы с большей вероятностью свернете себе шею, чем упав с лошади. Только не пытайтесь опровергнуть это утверждение.
Человек, принимающий антидепрессанты, в большинстве случаев снова будет страдать депрессией. Если же человек справился с подавленностью своими силами, он имеет все шансы навсегда забыть про это состояние.
В четырех дольках темного шоколада содержится порядка двухсот калорий. Так что если не хотите поправиться, лучше не есть больше двух долек в сутки.
Когда влюбленные целуются, каждый из них теряет 6,4 ккалорий в минуту, но при этом они обмениваются почти 300 видами различных бактерий.
Десять смертельных ядов и их действие на человека
по характерной зеленой пинии в спектре (tallos — зеленая почка). Химические свойства таллия определяются его принадлежностью к побочной группе a-переходных металлов III группы элементов таблицы Менделеева.
Атомный вес таллия 204,39, атомный номер 81, плотность 11,85 г/см°. Температура плавления 303 С, температура кипения 1460°С.
Упругость паров таллия при температуре 825°С — 1, при 983 С — 10, при 1040°С — 20. при 1457°С — 760 мм-рт. ст. В химических соединениях он выступает как одновалентный или трехвалентный металл, образуя два рода соединений — закисные и окисные. На воздухе таллий покрывается пленкой закиси; при 100°С быстро окисляется с образованием TI2O и Tl2O3. С хлором, бромом и йодом реагирует при комнатной температуре. При взаимодействии со спиртами образует алкоголяты.
Легко растворяется в HNO3, Существуют соли и одно- и трехвалентного таллия (В.К. Григорович, 1970). Таллий является редким рассеянным элементом. Характер распределения его в природе определяется близостью по химическим свойствам и размерам ионных радиусов к щелочным металлам, а также к калькофильным элементам.
Промышленное значение как источники сырья для получения таллия имеют товарные концентраты сульфидов (сфалерит, галенит, пирит и марксцит). Таллий не извлекается непосредственно из руд и концентратов, содержащих его в количествах не выше тысячных долей процента.
Сырьем для промышленного его получения служат отходы и полупродукты производства цветных металлов. Содержание таллия в этих материалах колеблется в значительных пределах (от сотых допей процента до целых) и зависит не только от содержания таппия в исходном сырье, но и от характера производства и принятой технологии получения основного металла.
Таким образом, извлечение таллия связано с комплексной переработкой сырья и осуществляется попутно с получением других металлов. При низкой концентрации таллия в перерабатываемом cырье технология его производства на первой стадии сводится обычно к получению концентрата таппия, который затем перерабатывается на технический металл или его сопи.
В Советском Союзе производство таллия организовано на ряде свинцовых и цинковых заводов (Т.И. Дарвойд с соавт., 1968).
Окислы таллия
Известны 3 соединения таллия с кислородом: закись — Tl2O, охись — Tlg2O3 и перекись -Tl2O3 (мало изучена).
Одним из химических элементов, который относится к металлической группе, является талий. Таллий в организме человека всегда присутствует в небольшом количестве. Несмотря на это контакта с ним следует избегать, поскольку приводит к тяжелой форме интоксикации. Таллий имеет ядовитое действие на человека.
История [ править | править код ]
Таллий был открыт спектральным методом в 1861 году английским учёным Уильямом Круксом в шламах свинцовых камер сернокислотного завода вблизи города Аббероде, расположенным в горном массиве Гарц.
Металлический таллий был независимо получен Уильямом Круксом и французским химиком Клодом-Огюстом Лами в 1862 году [5] .
Происхождение названия [ править | править код ]
Название элемент получил по характерным зелёным линиям своего спектра и зелёной окраске пламени. От др.-греч. θαλλός — молодая, зелёная ветвь [6] .
Что собой представляет талий и возможные способы отравления им
Прежде чем выяснить, где можно отравиться, необходимо ответить на вопрос: соли таллия — что это? Это сильнодействующий токсин, который поражает периферическую и центральную нервную систему, почки, желудочно-кишечный тракт. В промышленности его используют намного реже, чем другие металлы. Важно помнить, что любой контакт с ним в большинстве случаев заканчивается смертью, поскольку является сильнодействующим ядом.
Во время многочисленных экспериментов данный химический элемент был выявлен в организме человека в большем количестве именно в жировых тканях. По сегодняшний день его функции и предназначение в нашем организме остаются большой загадкой. В растениях находится его минимальное количество. Поэтому ученые считают, что таллий (или thallium) попадает в организм человека именно с растительными продуктами. Концентрация настолько мала, что никакого вреда здоровью он не причиняет.
Важно знать, где содержится яд. Интоксикация может произойти в одной из следующих ситуаций:
- Работа с пестицидами или инсектицидами. Большая часть отравлений наблюдается у работников сельского хозяйства.
- Во время работы на производстве, где используют талий. Например, производство пиротехники, термометров, красок флуоресцентных и лампочек.
- Металл входит в состав ядов для грызунов, поэтому отравление может произойти во время обработки помещения против грызунов.
- Чаще всего дети травятся от попадания вовнутрь средства, которое содержит пестициды таллия. Так важно прятать от ребенка все отравы, растворы и химикаты, ведь он еще ничего не знает о предстоящей опасности. Для маленького организма даже самое минимальное количество подобного вещества может стать последним.
Во время работы с таллием обязательно надевается респиратор и защитный костюм.Для отравления не всегда нужен контакт с кожей, достаточно сульфат талию попасть в организм через дыхательные пути. Очень часто этот химический элемент используют для того, чтобы намеренно убить человека.
Ссылки
| в Викисловаре |
| в Викицитатнике |
| в Викитеке |
- [www.n-t.org/ri/gd/yd.htm Ида Даниловна Гадаскина «Яды — вчера и сегодня: Очерки по истории ядов»]
- [www.vokrugsveta.ru/vs/?article_id=1373 Журнал «Вокруг Света»: Ядовитая эволюция]
- [www.stopusa.be/scripts/texte.php?section=CL&langue3&id=24471 Spraying of Agent orange by US Army in Vietnam and its consequences] (англ.)
- [www.monde-solidaire.org/spip/article.php3?id_article=2295 Epandage de l’Agent Orange par l’US Army au Viêt Nam et ses conséquences] (фр.)
- [essuir.sumdu.edu.ua/handle/123456789/4836 Метаболические яды и сосуды]
| Это заготовка статьи по токсикологии. Вы можете помочь проекту, дополнив её. |
Действие таллия на организм
Выше мы выяснили, что данный металл имеет 3 пути попадания в организм:
- контакт с кожей,
- через пищеварительную систему,
- через дыхательные пути.
Таллий имеет ядовитое действие на организм человека. Достаточно 1 грамма для отравления. Большее количество приводит к смерти. Самое быстрое и тяжелое отравление наблюдается в ситуациях когда таллий (thallium) проглотили. Попадание его в желудок приводит к локальному воспалению. Достаточно менее часа для того, чтобы этот яд распространился по всему организму. Больше всех страдают почки, поскольку лишь они способны вывести его из организма. А именно происходит нарушение их функций, поскольку таллий оседает на внутренних стенках органов. Выводится из организма очень и очень медленно. Понадобится до 3-х месяцев, чтобы полностью очистить организм от небольшого количества яда.
Не только почки, но и все остальные жизненно важные органы страдают от интоксикации. В сердце, нервных клетках головного мозга, печени, нервных путях и сосудах наблюдается оседание металла. В более тяжелых случаях отмечается отек головного мозга. Как правило, именно это становится причиной всех смертей в ходе отравления.
Возможные осложнения
Тяжелые отравления таллием заканчиваются летальным исходом. Но и более легкие отравления имеют неблагоприятный прогноз, так как приводят к многочисленным отдаленным последствиям:
- тремор конечностей;
- атаксия;
- нарушения памяти;
- инсульт;
- инфаркт миокарда;
- гормональные расстройства;
- хронические заболевания легких;
- хронические заболевания пищеварительной системы;
- бесплодие;
- нарушения потенции у мужчин и менструальной функции у женщин;
- повышенный риск врожденных патологий у потомства.
Проявления отравления таллием
Сложность интоксикации напрямую зависит не только от количества принятого яда, но и от возраста пострадавшего и его веса. Ребенку необходимо намного меньше времени и количества химиката для развития отравления.
Спустя первые 2 часа можно наблюдать, как начинают проявляться первые симптомы. Общее состояние пострадавшего начинает быстро ухудшаться и спустя это время можно наблюдать полную клиническую картину. Первые симптомы отравления таллием:
- Острая боль в животе, которая быстро распространяется. В этот момент поражаются все отделы кишечника и желудка.
- Тошнота, после чего следует рвота. Обычно рвотная масса состоит из желудочного сока, желчи и остатков съеденного.
- Вследствие поражения кишечника наступает диарея, которая сопровождается кровью. Это вызвано кровотечением в кишечнике.
- Учащенный ритм сердца или тахикардия могут привести в скором времени к постоянно нарушенному ритму сердца.
- Частое дыхание.
- Наблюдается падание артериального давления. Это вызвано внутренним кровотечением в области кишечника.
Если вовремя не обратиться за медицинской помощью, то на протяжении следующей недели добавляются такие симптомы:
- приступы судорог, которые очень напоминают эпилепсию,
- сильная и постоянная головная боль находится в одной части головы,
- апатия, ярко выраженная слабость всего организма,
- миалгия, так званая мышечная боль, которая локализируется в нижних конечностях,
- пошатывания, нарушенная координация, особенно заметна при ходьбе. Это говорит о том, что таллий повредил мозжечок,
- воспаление нервных путей или полиневрит, который проявляется болями во всем теле,
- резкое ухудшение зрения, в особо запущенных и тяжелых формах наступает полная слепота, что говорит о поражении в головном мозге зрительного центра,
- потеря сознания, наблюдаются глубокие коматозные состояния.
В случаях острых и тяжелых отравлений пострадавший умирает в течение первых суток вследствие отека мозга или внутреннего кишечного кровотечения.
Газ зарин
Зарин является одним из самых опасных и смертельных нервных газов
, который в сотни раз токсичнее цианида. Изначально зарин был произведен в качестве пестицида, но вскоре этот прозрачный газ без запаха стал мощным химическим оружием.
Человек может отравиться зарином при вдыхании или воздействии газа на глаза и кожу. Вначале могут появиться такие симптомы, как насморк и стеснение в груди, дыхание затрудняется и возникает тошнота
.
Затем человек теряет контроль над всеми функциями своего тела и впадает в кому, возникают конвульсии и спазмы, пока не наступает удушье.
Первая медицинская помощь при отравлении
Если есть подозрения, что произошла интоксикация таллием, необходимо вызвать скорую помощь, не дожидаясь первых симптомов. Ведь каждая минута важна. Первая помощь и дальнейшее лечение осуществляется лишь медперсоналом в стационарных условиях.
Все что вы можете — это провести правильную доврачебную помощь. Таким образом, вы выведите собравшиеся частички талия в желудке и уменьшите тяжесть всего дальнейшего процесса отравления. Следующие мероприятия вы можете провести самостоятельно:
- Очищение желудка. Если яд был проглочен, то данное мероприятие рекомендуется провести в первые минуты. Для этого пострадавшему необходимо выпить залпом более 1-го литра простой воды, после чего вызвать рвотный рефлекс. Для того чтобы спровоцировать рвотный позыв, надавите на корень языка. Необходимо повторить данную процедуру несколько раз. Это поможет вывести из желудка максимальное количество яда. Если наблюдается нарушение сознания, то такая промывка категорически запрещается. Также следует прекратить в случаях, когда рвота имеет темный или даже черный цвет. Такой цвет может говорить лишь о начавшемся внутреннем кровотечении. А промывание лишь усилит его и увеличит объем кровопотери.
- Сорбенты. Стоит заглянуть в аптечку. Возможно, там найдутся препараты группы сорбентов. Внимательно прочтите инструкцию, чтобы понять, какую необходимо больному принять дозировку. Например, на 10 кг веса необходима 1 таблетка активированного угля.
- Питье. Это должна быть простая вода. Именно питье поможет снять обезвоживание, которое может возникнуть в процессе отравления. Следует обратить внимание на температуру воды. Она должна быть комнатной, ни в коем случаи не горячей. Также следует избегать газированных напитков.
Лишь прибывшие на вызов медики могут оказать первую медицинскую помощь. Она состоит из следующих мероприятий:
- вводятся препараты, которые устраняют нарушение дыхания и сердцебиения,
- ставятся специальные капельницы, которые снимают интоксикационный синдром,
- при выраженном кишечном кровотечении вводятся кровоостанавливающие препараты,
- если наблюдается неукротимая рвота, то даются противорвотные средства,
- маленьким детям или пострадавшим с нарушенным сознанием делают промывку желудка через зонд.
После того как все жизненно важные показатели стабилизировались, его везут в ближайшую больницу. Там проводится госпитализация в токсикологическое отделение или в реанимацию.
Отрывок, характеризующий Яд
– Здесь. Какова молния! – переговаривались они. В покинутой корчме, перед которою стояла кибиточка доктора, уже было человек пять офицеров. Марья Генриховна, полная белокурая немочка в кофточке и ночном чепчике, сидела в переднем углу на широкой лавке. Муж ее, доктор, спал позади ее. Ростов с Ильиным, встреченные веселыми восклицаниями и хохотом, вошли в комнату. – И! да у вас какое веселье, – смеясь, сказал Ростов. – А вы что зеваете? – Хороши! Так и течет с них! Гостиную нашу не замочите. – Марьи Генриховны платье не запачкать, – отвечали голоса. Ростов с Ильиным поспешили найти уголок, где бы они, не нарушая скромности Марьи Генриховны, могли бы переменить мокрое платье. Они пошли было за перегородку, чтобы переодеться; но в маленьком чуланчике, наполняя его весь, с одной свечкой на пустом ящике, сидели три офицера, играя в карты, и ни за что не хотели уступить свое место. Марья Генриховна уступила на время свою юбку, чтобы употребить ее вместо занавески, и за этой занавеской Ростов и Ильин с помощью Лаврушки, принесшего вьюки, сняли мокрое и надели сухое платье. В разломанной печке разложили огонь. Достали доску и, утвердив ее на двух седлах, покрыли попоной, достали самоварчик, погребец и полбутылки рому, и, попросив Марью Генриховну быть хозяйкой, все столпились около нее. Кто предлагал ей чистый носовой платок, чтобы обтирать прелестные ручки, кто под ножки подкладывал ей венгерку, чтобы не было сыро, кто плащом занавешивал окно, чтобы не дуло, кто обмахивал мух с лица ее мужа, чтобы он не проснулся. – Оставьте его, – говорила Марья Генриховна, робко и счастливо улыбаясь, – он и так спит хорошо после бессонной ночи. – Нельзя, Марья Генриховна, – отвечал офицер, – надо доктору прислужиться. Все, может быть, и он меня пожалеет, когда ногу или руку резать станет. Стаканов было только три; вода была такая грязная, что нельзя было решить, когда крепок или некрепок чай, и в самоваре воды было только на шесть стаканов, но тем приятнее было по очереди и старшинству получить свой стакан из пухлых с короткими, не совсем чистыми, ногтями ручек Марьи Генриховны. Все офицеры, казалось, действительно были в этот вечер влюблены в Марью Генриховну. Даже те офицеры, которые играли за перегородкой в карты, скоро бросили игру и перешли к самовару, подчиняясь общему настроению ухаживанья за Марьей Генриховной. Марья Генриховна, видя себя окруженной такой блестящей и учтивой молодежью, сияла счастьем, как ни старалась она скрывать этого и как ни очевидно робела при каждом сонном движении спавшего за ней мужа. Ложка была только одна, сахару было больше всего, но размешивать его не успевали, и потому было решено, что она будет поочередно мешать сахар каждому. Ростов, получив свой стакан и подлив в него рому, попросил Марью Генриховну размешать. – Да ведь вы без сахара? – сказала она, все улыбаясь, как будто все, что ни говорила она, и все, что ни говорили другие, было очень смешно и имело еще другое значение. – Да мне не сахар, мне только, чтоб вы помешали своей ручкой. Марья Генриховна согласилась и стала искать ложку, которую уже захватил кто то. – Вы пальчиком, Марья Генриховна, – сказал Ростов, – еще приятнее будет. – Горячо! – сказала Марья Генриховна, краснея от удовольствия. Ильин взял ведро с водой и, капнув туда рому, пришел к Марье Генриховне, прося помешать пальчиком. – Это моя чашка, – говорил он. – Только вложите пальчик, все выпью. Когда самовар весь выпили, Ростов взял карты и предложил играть в короли с Марьей Генриховной. Кинули жребий, кому составлять партию Марьи Генриховны. Правилами игры, по предложению Ростова, было то, чтобы тот, кто будет королем, имел право поцеловать ручку Марьи Генриховны, а чтобы тот, кто останется прохвостом, шел бы ставить новый самовар для доктора, когда он проснется. – Ну, а ежели Марья Генриховна будет королем? – спросил Ильин. – Она и так королева! И приказания ее – закон. Только что началась игра, как из за Марьи Генриховны вдруг поднялась вспутанная голова доктора. Он давно уже не спал и прислушивался к тому, что говорилось, и, видимо, не находил ничего веселого, смешного или забавного во всем, что говорилось и делалось. Лицо его было грустно и уныло. Он не поздоровался с офицерами, почесался и попросил позволения выйти, так как ему загораживали дорогу. Как только он вышел, все офицеры разразились громким хохотом, а Марья Генриховна до слез покраснела и тем сделалась еще привлекательнее на глаза всех офицеров. Вернувшись со двора, доктор сказал жене (которая перестала уже так счастливо улыбаться и, испуганно ожидая приговора, смотрела на него), что дождь прошел и что надо идти ночевать в кибитку, а то все растащат.
Обследование и лечение пострадавшего
В организме не так просто выявить таллий. Для этого рентгенологически исследуют брюшную полость. Его можно увидеть на снимке, поскольку он не пропускает рентгеновские лучи. Он может собираться в области почек или кишечника.
Отравление таллием является очень серьезным, поэтому лечение начинается в минуты госпитализации. Оно состоит из следующих компонентов:
- Вводится дитиокарб – это антидот таллия. Благодаря ему нейтрализуются и выводятся токсины с организма. Но улучшение не происходит мгновенно.
- Гемодиализ также помогает вывести токсины с организма. Проводится в первые сутки отравления. Помогает предотвратить острую почечную недостаточность.
- Если отсутствует кишечное кровотечение, то применяют слабительные препараты.
- Вводятся медикаменты для нормализации и поддержания давления и работы сердца.
- Капельницы, которые направлены на нормализацию давления, а также снижение интоксикации. Любой препарат вводится под строгим контролем электролитного состава крови.
Нахождение в природе [ править | править код ]
Таллий — рассеянный элемент. Содержится в обманках и колчеданах цинка, меди и железа, в калийных солях и слюдах. Таллий — тяжёлый металл. Известно лишь семь минералов таллия (круксит (Cu, Tl, Ag)2Se, лорандит TlAsS2, врбаит Tl4Hg3Sb2As8S20, гутчинсонит (Pb, Tl)S • Ag2S • 5As2S5, авиценнит Tl2O3), все они крайне редкие. Главная масса таллия связана с сульфидами и прежде всего с дисульфидами железа. В пирите он установлен в 25 % проанализированных образцов. Его содержание в дисульфидах железа нередко составляет 0,1—0,2 %, а иногда достигает 0,5 %. В галените содержание таллия колеблется от 0,003 до 0,1 % и редко более. Высокие концентрации таллия в дисульфидах и галенитах характерны для низкотемпературных свинцово-цинковых месторождений в известняках. Содержание таллия, достигающее 0,5 %, отмечается в некоторых сульфосолях. Небольшое количество таллия встречается во многих других сульфидах, например, в сфалеритах и халькопиритах некоторых медноколчеданных месторождений, содержание колеблется от 25 до 50 г/т . Наибольшее геохимическое сходство таллий имеет с K, Rb, Cs, а также с Pb, Ag, Cu, Bi. Таллий легко мигрирует в биосфере. Из природных вод он сорбируется углями, глинами, гидроксидами марганца, накапливается при испарении воды (например, в озере Сиваш до 5⋅10 −8 г/л). Содержится в калиевых минералах (слюде, полевых шпатах), сульфидных рудах: галените, сфалерите, марказите (до 0,5 %), киновари. Как примесь присутствует в природных оксидах марганца и железа [7] .
Среднее содержание таллия (по массе):
- в земной коре 4,5⋅10 −5 %;
- в ультраосновных породах 10 −6 %;
- в основных породах 2⋅10 −5 %;
- в морской воде 10 −9 %.
Какие могут быть последствия?
Во всех случаях отмечается, что интоксикация сульфатом таллия никогда не проходит бесследно, в независимости была ли оказана помощь своевременно и правильно или спустя некоторое время. Как правило, последствия остаются на всю жизнь. При более сложных отравлениях после выздоровления наблюдается полная потеря трудоспособности. Самые распространенные последствия после интоксикации:
- Аллопеция. Характерно как для мужчин, так и для женщин. Потеря волос может быть частичная, а может быть и полное облысение. Как правило, это последствие необратимо.
- Сетчатка глаза атрофируется. Это приводит к полной или частичной потери зрения.
- У мужчин импотенция, а у женщин нарушается менструальный цикл, возможно бесплодие.
- Почечная недостаточность вызвана поражением почек, в некоторых случаях пострадавший нуждается в постоянном гемодиализе.
- Атрофия кожи, дерматит, высыпания и покраснения.
- Сердечная недостаточность, которая переходит в хроническую.
- Депрессия.
- Нарушение памяти.
- Развитие эпилепсии.
В связи с тем, что таллий не такой распространенный металл, отравление им встречается редко, но оно намного серьезней, чем остальные. Важно помнить, что такое соли таллия и где содержится яд. Чаще всего страдают дети, которые употребили вещество, в состав которого входит сульфат таллия, или люди, работающие на производстве с его использованием. Для сохранения жизни необходимо вызывать скорую помощь при малейших подозрениях на интоксикацию. Врачам приходится бороться с большим количеством осложнений, которые могут возникнуть, поэтому период лечения и реабилитации является очень длительным. Даже при своевременной первой помощи пострадавший может навсегда остаться инвалидом.
Тетродотоксин
Этот смертельный яд содержится в органах рыб рода иглобрюхих
, из которых готовят известный японский деликатес «фугу». Тетродотоксин сохраняется в коже, печени, кишечнике и других органах, даже после того, как рыба была приготовлена.
Этот токсин вызывает паралич, судороги, психическое расстройство
и другие симптомы. Смерть наступает в течение 6 часов после попадания яда внутрь.
Известно, что каждый год несколько людей погибают от мучительной смерти при отравлении тетродотоксином после потребления фугу.
Получение [ править | править код ]
Технически чистый таллий очищают от других элементов, содержащихся в колошниковой пыли (Ni, Zn, Cd, In, Ge, Pb, As, Se, Te), растворением в тёплой разбавленной кислоте с последующим осаждением нерастворимого сульфата свинца и добавлением HCl для осаждения хлорида таллия (TlCl). Дальнейшая очистка достигается электролизом сульфата таллия в разбавленной серной кислоте с использованием проволоки из платины с последующим плавлением выделившегося таллия в атмосфере водорода при 350—400 °C.
Свойства [ править | править код ]
Таллий — блестящий серебристый мягкий металл с голубоватым оттенком. На воздухе быстро тускнеет, покрываясь чёрной плёнкой оксида таллия Tl2O [3] . В воде в присутствии кислорода растворяется с образованием TlOH, в отсутствие кислорода не реагирует, поэтому таллий хранят под слоем прокипячённой дистиллированной воды (или парафина, а также покрывают лаком) [3] .
Физические свойства [ править | править код ]
Существует в трёх модификациях. Низкотемпературная модификация Tl II является кристаллом гексагональной сингонии, пространственная группа P
63/
mmc
, параметры ячейки
a
= 0,34566 нм ,
c
= 0,55248 нм ,
Z
= 2 , решётка типа магния. Выше 234 °C существует высокотемпературная модификация Tl I кубической сингонии (объёмно-центрированная решётка), пространственная группа
Im
3
m
, параметры ячейки
a
= 0,3882 нм ,
Z
= 2 , решётка типа α-Fe; энтальпия перехода между модификациями I и II составляет 0,36 кДж/моль . При 3,67 ГПа и 25 °C — модификация Tl III кубической сингонии (гранецентрированная решётка), пространственная группа
Fm
3
m
, параметры ячейки
a
= 0,4778 нм ,
Z
= 4 . Температура плавления составляет 577 K (304 °C), кипит при 1746 K (1473 °C) [2] . Таллий относится к группе тяжёлых металлов; его плотность — 11,855 г/см 3 [2] .
Сечение захвата тепловых нейтронов атомом — 3,4 ± 0,5 барн. Конфигурация внешних электронов — 6s 2 6p. Энергии ионизации (в эВ): Tl 0 →Tl + →Tl 2+ →Tl 3+ →Tl 4+ соответственно равны 6,1080; 20,4284; 29,8; 50,0 [3] .
Таллий диамагнитен, массовая магнитная восприимчивость поликристаллического гексагонального таллия равна χ = −0,249·10 −9 м 3 /кг при нормальных условиях, −0,258·10 −9 м 3 /кг при T
= 14,2 К . У кубического поликристаллического таллия при
T
> 235 К массовая магнитная восприимчивость составляет −0,158·10 −9 м 3 /кг . Монокристаллический гексагональный таллий проявляет анизотропию, χ|| = −0,420·10 −9 м 3 /кг , χ⊥ = −0,164·10 −9 м 3 /кг . У жидкого таллия χ = −0,131·10 −9 м 3 /кг при температуре плавления [8] .
При температуре 2,39 K таллий переходит в сверхпроводящее состояние.
Спектр таллия в видимом диапазоне имеет яркую линию с длиной волны 525,046 нм (зелёный), благодаря которой этот элемент и получил своё название.
Химические свойства [ править | править код ]
Реагирует с неметаллами: с галогенами и кислородом при комнатной температуре, с серой, селеном, теллуром, фосфором — при нагревании. С мышьяком сплавляется без образования соединения. С водородом, азотом, углеродом, кремнием, бором, а также с аммиаком и сухим углекислым газом не реагирует.
Применение [ править | править код ]
- Амальгама таллия имеет низкую температуру плавления ( t
пл = −61 °C; более легкоплавкой является только эвтектика в системе натрий-калий-цезий с
t
пл = −78 °C ). Она находит применение для заполнения низкотемпературных термометров и в качестве теплоносителя. - Нуклид 201 Tl используется в медицине для кардиологических исследований.
- Таллий вводится в качестве активатора в кристаллы иодида натрия, использующегося в качестве сцинтиллятора для регистрации ионизирующих излучений.
- В инфракрасной оптике в качестве материалов линз применяются бромид и иодид таллия(I). Кроме того, в годы Великой Отечественной войны оксисульфид таллия (таллофид) применялся в качестве чувствительного элемента приборов ночного видения [9] .
- Иодид таллия(I) добавляют в осветительные металлогалогеновые лампы.
- Раствор Клеричи, состоящий из формиата таллия (HCOOTl) и малоната таллия (CH2(COOTl)2), используется в минералогии для определения свойств минералов.
- Сульфат таллия(I) и карбонат таллия(I) ранее применялись в качестве средства для борьбы с грызунами в труднодоступных местах.
- Трёхвалентный таллий является основным компонентом некоторых относительно сильных
окислительных реагентов в органическом синтезе:
- Трифторацетат таллия(III) или трис(трифторацетат) таллия, TTFA (Tl(Otfac)3); [10]
- Тринитрат таллия, TTN (Tl(NO3)3);
- Триацетат таллия, TTA (Tl(CH3COO)3).
Здоровье твоей планеты в твоих руках!
| Внешний вид простого вещества | |
| Мягкий серебристо-белый металл с голубоватым оттенком | |
| Свойства атома | |
| Название, символ, номер | Та́ллий / Thallium (Tl), 81 |
| Атомная масса (молярная масса) | [204,382; 204,385] [комм 1] [1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f 14 5d 10 6s 2 6p 1 |
| Радиус атома | 171 пм |
| Химические свойства | |
| Ковалентный радиус | 148 пм |
| Радиус иона | (+3e) 95 (+1e) 147 пм |
| Электроотрицательность | 1,62 (шкала Полинга) |
| Электродный потенциал | Tl←Tl + −0,338 В Tl←Tl 3+ 0,71 В |
| Степени окисления | 3, 1 |
| Энергия ионизации (первый электрон) | 588,9 (6,10) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 11,849 [2] г/см³ |
| Температура плавления | 577 K (304 °C, 579 °F) [2] |
| Температура кипения | 1746 K (1473 °C, 2683 °F) [2] |
| Уд. теплота плавления | 4,31 кДж/моль |
| Уд. теплота испарения | 162,4 кДж/моль |
| Молярная теплоёмкость | 26,3 [3] Дж/(K·моль) |
| Молярный объём | 17,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,456 c=5,525 [4] |
| Отношение c / a | 1,599 |
| Температура Дебая | 96,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 38,9 [3] Вт/(м·К) |
| Номер CAS | 7440-28-0 |
| 4f 14 5d 10 6s 2 6p 1 | |
| Кристалическая структура: гексагональная Таллий (лат. thallium), tl, химический элемент iii группы периодической системы Менделеева, атомный номер 81, атомная масса 204,37; на свежем разрезе серый блестящий металл; относится к редким рассеянным элементам. В природе элемент представлен двумя стабильными изотопами 203 tl (29,5%) и 205 tl (70,5%) и радиоактивными изотопами 207 tl — 210 tl — членами радиоактивных рядов . Искусственно получены радиоактивные изотопы 202 tl (t 1/2 = 12,5 сут ) , 204 tl (t 1/2 = 4,26 года) и 206 tl (t 1/2 = 4,19 мин ) . Т. открыт в 1861 У. Круксом в шламе сернокислотного производства спектроскопическим методом по характерной зелёной линии в спектре (отсюда название: от греч. thall o s — молодая, зелёная ветка). В 1862 французский химик К. О. Лами впервые выделил Т. и установил его металлическую природу. Распространение в природе. Среднее содержание Т. |