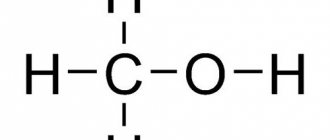Фульвовая кислота — это один из двух классов гумусовых кислот — органических соединений, присутствующих в грунте, осадочных породах и водоемах.
Будучи активным химическим соединением, фульвовая кислота помогает нашему организму лучше поглощать и использовать питательные вещества, такие как микробиота/пробиотики, антиоксиданты, жирные кислоты и минералы.
Данная кислота считается уникальным «усилителем питательных веществ». Мы можем получить пользу, принимая ее в виде добавок или естественным образом, посредством контакта с большим количеством грязи/почвы на открытом воздухе.
Благодаря своей способности улучшать поглощение нашими клетками таких веществ, как антиоксиданты и электролиты, фульвовая кислота стала популярным средством для замедления старения, улучшения здоровья желудочно-кишечного тракта и защиты функции мозга. ()
Уникальная химическая структура позволяет фульвокислоте бороться с повреждениями, вызванными свободными радикалами, которые способствуют старению и связаны практически с каждым хроническим заболеванием.
Химические свойства
Оротовая кислота по внешнему виду — это белый порошок, кристаллической структуры без специфического запаха и цвета. Он плохо растворяется в воде, трудно – в кипящей жидкости. Вещество нерастворимо в метиловом, этиловом спирте, хлороформе, хорошо растворяется в р-ре гидроксида натрия. Гетероциклическое соединение разрушает при воздействии яркого света. Молекулярная масса средства = 156,1 грамма на моль.
Это витаминоподобное вещество, которое оказывает влияние на обменные процессы и стимулирует рост живых организмов, но не обладает св-ми витаминов. Кислоту открыли в 1904 году, вещество выделили из коровьего молока. Она была обнаружена в составе человеческого молока и названа витамином B13. К сожалению Оротовая кислота не синтезируется микрофлорой человека (желудка) и поэтому ее относят к витаминоподобным веществам.
Средство находится в пищевых продуктах и поступает в организм с минералами и слаборастворимыми в воде соединениями. Благотворно влияет на работу печени, ЖКТ, сердечной мышцы, белковый обмен, сосудов и мышц. Активно применяется Оротовая кислота в косметологии. Считается, что она симулирует обменные процессы, протекающие в коже, активирует синтез нуклеиновых кислот и белка.
Средство выпускают в виде солей, в таблетках по 100 и 500 мг и гранулах.
Что делать при отравлении парами кислоты в домашних условиях
В России сложно найти соляную высококонцентрированную кислоту в открытой продаже. Но даже при небольшой концентрации возможно отравления ее парами. В быту многие неосторожно обращаются с ядовитыми веществами и не используют средства защиты дыхательных путей и кожи. Распространенные причины несчастных случаев переливание кислоты, приготовление растворов или использование для промывания газового оборудования, аккумуляторов без соблюдения особой осторожности.
При появлении первых аспирационных симптомов отравления срочно нужно обеспечить проветривание помещения, открыть окна и двери. Если чувствуете запах хлора, першение в горле и приступы кашля необходимо срочно подниматься на возвышенность, верхние этажи зданий, лестницы, чердак дома или крышу. Молекулы пара кислоты тяжелее воздуха, газ стелется по полу. Нужно задержать дыхание, закрыть глаза, укрыть незащищенные участки тела, как можно быстрее отдалиться от места аварии. При тяжелых состояниях пострадавшего эвакуируют из места поражения.
При потере сознания в результаты отравления соляной концентрированной кислотой человека нужно перевернуть на бок, наблюдать за его состоянием, чтобы он не захлебнулся рвотными массами.
Слизистые носа, ротовой полости и кожа промываются 2% раствором пищевой соды. Для его приготовления надо взять 1 стакан или 200 мл чистой прохладной воды и растворить в ней 1 чайную ложку порошка соды. Можно промывать от кислоты рот, слизистые глаз проточной водой до исчезновения симптомов раздражения. Применяются глазные капли для снятия воспаления и обезболивания с раствором Новокаина 2% по 1-2 капли в каждый глаз каждые 3-4 часа, Визин или аналоги для уменьшения красноты и жжения по 3 капли в каждый глаз каждые 2 часа. Для ингаляции применяется аналогичный раствор пищевой соды.
Для уменьшения отравления соляным парами всего организма показано обильное питье, лучше с щелочью (пример, минеральная вода Ессентуки без газа).
В случаи интоксикации нельзя накладывать повязки с мазями. Можно использовать только нейтрализующие вещества для данной кислоты – вода, гидрокарбонат натрия.
Фармакодинамика и фармакокинетика
Витаминоподобное вещество Оротовая кислота принимает активное участие в синтезе пиримидиновых нуклеотидов, составной части нуклеиновых кислот, из которых дальше образуются молекул белка. Вещество оказывает влияние на процессы регенерации клеток печени, снижает риск возникновения ожирения печени, снижает уровень холестерина в крови, благотворно влияет на работу сердца, репродуктивной системы, мышц и сосудов.
Средство, после приема внутрь, всасывается в ЖКТ, но не полностью, в кровь попадает приблизительно десятая доля от принятой дозы. Метаболизируется средство в печени, образуется метаболит оротидин-5-фосфат. Порядка 30% вещества подвергается процессам метаболизма и выводится с помощью почек.
Особенности обращения
Высококонцентрированная соляная кислота — едкое вещество
, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен.
Показания к применению
Лекарство назначают:
- в рамках проведения комплексной терапии при стенокардии, инфаркте миокарда, аритмии (мерцательная, из-за недостатка магния), хронической сердечной недостаточности;
- в качестве дополнительного средства при гепатозе, гепатите и других болезнях печени;
- при лечении заболеваний желчевыводящих путей, при острой и хронической интоксикации;
- для лечения алиментарной и алиментарно-инфекционной дистрофии в детском возрасте;
- при атеросклерозе, ангиоспазме, гиперлипидемии;
- в составе комплексного лечения миокардиодистрофии, дерматозов;
- при прогрессирующей мышечной дистрофии, анемии;
- в качестве общеукрепляющего средства при повышенных физических нагрузках, в период реконвалесценции.
Инструкция
Есть несколько форм фульвокислоты: ()
Жидкая или «водная» фульвовая кислота: По некоторым данным, фульвовая кислота обладает большей биологической доступностью, если принимать ее в жидкой форме, которую пищеварительной системе не нужно расщеплять перед использованием необходимых питательных веществ. По-видимому, в жидкой форме фульвовая кислота легче попадает в клетки. Внимательно изучите рекомендации по дозировке, поскольку передозировка может изменить уровень минералов потенциально опасным образом. Большая часть жидких продуктов продается в виде экстракта, около 12 капель которого необходимо разводить в 500-600 мл чистой питьевой воды.
Твердые добавки фульвокислоты: Сама по себе фульвовая кислота желтого цвета и не отличается привлекательным вкусом. Поэтому многие предпочитают добавлять ее в виде порошка в соки и смузи, позволяющие замаскировать неприятный вкус. Вы можете добавить фульвокислоту в жидкость или принимать совместно с добавками, что позволит усилить их эффект и увеличить биодоступность. Рекомендуется разводить фульвокислоту только в фильтрованной воде (никакой воды из-под крана или хлорированной воды). Жидкие продукты могут стерилизоваться в меньшей степени, что сохраняет больше пользы и питательных веществ, поэтому избегайте добавок, содержащих «стерильные гумусовые кислоты».
Органические культуры: несмотря на то, что этот способ косвенный, вы можете получить фульвокислоту, употребляя в пищу органические продукты. Дело в том, что фульвовая кислота используется для естественного пополнения минералов и других питательных веществ в почве и обычно присутствует в натуральных удобрениях для органических культур. Выбирайте органические продукты, в которых гораздо больше пользы. К сожалению, современные методы ведения хозяйства не позволяют обогащать почву, и вместо этого фермеры слишком плотно засаживают поля, используют пестициды, гербициды и фунгициды для подавления естественных микробных штаммов, которые нам необходимы.
Взаимодействие
Препараты, обволакивающие ЖКТ и обладающие вяжущими свойствами замедляют всасывание данного вещества.
Эффективность средства снижается при сочетанном приеме с пероральными контрацептивами, диуретиками, миорелаксантами, инсулином, глюкокортикостероидами.
Оротат калия (соль оротовой кислоты) снижает токсическое воздействие сердечных гликозидов.
Оротовая кислота при приеме с препаратами железа, тетрациклинами, фторидом натрия (если промежуток между приемами составляет менее 3 часов) замедляет всасывание лек. средств.
В каком случае обязательно обратиться к врачу
При попадании кислоты на кожу с образованием ожога первой степени (покраснение верхнего слоя эпидермиса) можно самостоятельно вылечить поражение в домашних условиях. Если после оказанной первой помощи, человеку становится хуже, увеличился пульс и сердцебиение, изменился цвет кожи и склер, возникает рвота, моча окрашена красноватым оттенком, то срочно надо обращаться за помощью в медицинское учреждения для устранения отравления организма соляными опасными кислотами.
При поражении глаз следует обращаться к офтальмологу, если симптомы спустя 6 часов не стихают, а зрение снижается.
В реанимационных мероприятиях нуждаются люди с тяжелыми ожогами кожных покровов и отравлением кислотой. Стоит немедленно предоставить им необходимую помощь, чтобы избежать шокового состояния и присоединения инфекции к раневой поверхности. Опасно для жизни состояние поражение организма, сопровождающееся внутренним кровотечением.
При первых признаках отравления в результате воздействия кислотно-соляных веществ следует безотлагательно провести мероприятия первой помощи, проконсультироваться с врачом о дальнейшей тактике.
Какой информации не хватает в статье?
- Список эффективных медикаментов
- Детальный обзор народных методов лечения
- Профессиональное мнение специалиста
- Детальный обзор антидотов
Отзывы
Отзывы о применении Оротовой кислоты оставляют в основном спортсмены, которые используют ее в сочетании с прочими препаратами и пациенты с сердечными заболеваниями (вещество назначают в комбинации с магнием). Отзывы в основном положительные. Из побочных реакций, чаще всего жалуются на несварение желудка, жидкий стул. Аллергические реакции возникают редко и не требуют назначения антигистаминных препаратов. После прекращения приема лекарства аллергия проходит самостоятельно.
Стационарное лечение интоксикации
Направление на стационарное лечение пациента в результате отравления зависит от степени ожога и наличии интоксикации соляными веществами.
Методы активной детоксикации кислоты:
- введение внутривенно обезболивания,
- промывание желудка при помощи зонда холодной водой, форсированный диурез с ощелачиванием крови,
- глотание небольших и не острых кусков льда,
- обильное питье раствора 4% пищевой соды до 1500 мл при появлении потемнения мочи и развитии метаболического ацидоза после соляного вещества,
- при возникновении массивного кровотечения во время отравления делают переливание крови.
Дополнительно включают в лечение антибиотики и гормоны, диагностику и исследования для наблюдения работы систем организма.
Использование на производстве
Она имеет широкое применение в металлургической, пищевой и медицинской промышленности.
HCL используется в различных отраслях, при этом концентрация ее может быть довольно велика.
- Металлургии. Применение при паянии, лужении и зачистке металлов.
- Пищевая промышленность. Применение при производстве пищевых регуляторов кислотности, к примеру, Е507.
- Гальванопластика. Используется при травлении.
- Медицине. Находит свое применение при производстве искусственного желудочного сока.
Входит в состав синтетических красителей. Используется при производстве чистящих и моющих средств. Но в жидкостях, предназначенных для бытового использования, концентрация серной кислоты незначительна.
Интоксикация соляной кислотой: симптомы
Симптомы отравления соляной кислотой различаются по тому, как оно произошло. Выделяют три способа проникновения яда в организм:
- глотание,
- вдыхание,
- через кожные покровы.
Для каждого из них характерны отличительные признаки, которые необходимо знать человеку.
При проглатывании
Отравление соляной кислотой через ротовую полость происходит в случае глотания яда. Как правило, чаще всего такое случается у людей, склонных к суициду и детей, выпивших вещество в результате невнимательности родителей. В этом случае отмечаются следующие признаки:
- боль и жжение в полости рта,
- тошнота, рвота коричнево-черного цвета, часто с примесью крови,
- сильный кашель,
- обильное слюноотделение,
- болезненные ощущения в пищеводе, желудке, за грудиной,
- язык приобретает черную окраску,
- кожа может стать желтого оттенка,
- появляются болезненные ощущения в правом боку из-за нарушения работы печени.
Через дыхательные пути
Отравление парами соляной кислоты не менее опасно, чем при проглатывании этого вещества.
Оно также оказывает довольно разрушительное действие. Возникает, как правило, на производстве, связанном с этим ядом. При этом наблюдаются следующие симптомы:
- голос становится хриплым,
- появляются боли в носоглотке,
- возникает сильный кашель,
- возможны болезненные ощущения в груди,
- при сильном отравлении возникает отек гортани,
- человек начинает задыхаться.
При отсутствии необходимой помощи, у пострадавшего при отравлении парами может развиться отек легких, который в последствие может стать причиной летального исхода.
Попадание на кожу
Это нельзя назвать отравлением в полном смысле этого слова. Однако попадание кислоты на кожные покровы приносит человеку немало страданий и неприятностей. Возникает ожог.
При этом наблюдаются следующие признаки:
- покраснение участка кожи,
- сильная боль,
- образование волдырей,
- изменение цвета кожи на более светлый или, наоборот, темный.
При отсутствии помощи возможно отмирание тканей.
Кроме этого, можно отметить общие признаки для отравления соляной кислотой независимо от способа:
- головные боли,
- снижение давления,
- тахикардия,
- возможно повышение температуры,
- потеря сознания.
Из внутренних органов в первую очередь страдает печень, как орган, отвечающий за очищение организма от токсинов. В последствие начинает нарушаться функциональность почек, вплоть до почечной недостаточности.
У человека может развиться шок от ожога кислотой, что станет причиной смерти.
Травление в водных растворах кислот
Среди металлов по количеству подлежащей удалению окалины, в особенности перед горячими методами покрытий, первое место занимают железо и низколегированные стали. Основными травителями для удаления с них окалины являются серная и соляная кислоты. Каждая из этих кислот имеет свои преимущества и недостатки как технического, так и экономического характера. В трудах IV Международной конференции ассоциации по горячему цинкованию указывается, что из 22 английских фирм только одна осуществляет травление в серной кислоте, все остальные — в соляной, а в трудах V конференции той же организации, которая проходила в 1958 г. в Бельгии и Голландии, в качестве травителя рассматривалась только соляная кислота. Таким образом, можно считать, что по крайней мере на крупных предприятиях для удаления окалины имеется тенденция к преимущественному применению соляной кислоты. Указывается также на возможность травления соляной кислотой в замкнутом цикле, при котором расход кислоты определяется не столько реакциями, растворения окислов, сколько механическим уносом и остатком в отработанном растворе при регенерации.
При взаимодействии окисленного железа с разбавленными растворами кислот происходит растворение окислов и металлического железа. С растворами соляной кислоты протекают следующие реакции: FeO + 2НCl → FeCl2 + H2O, Fe2O3 + 6НCl → 2FeCl3 + 3H20, Fe3O4 + 8НCl → 2FeCl3 + FeCl2 + 4H2O, Fe + 2HCl → FeCl2 + 2H, 2FeCl3 + 2H → 2FeCl2 + 2HCl, 2FeCl3 + Fe → 3FeCl2.
Аналогично протекают реакции с серной кислотой.
Из этих реакций с наибольшей скоростью протекают реакция растворения металлического железа с выделением водорода и реакция растворения закиси железа.
Процессы травления окисленного железа путем непосредственного воздействия на него растворов кислот без применения электрического тока от внешнего источника принято называть химическим травлением, в отличие от электрохимического, которое осуществляется с применением электрического тока из внешней сети. Между тем есть основание считать, что так называемые химические методы травления по существу являются электрохимическими. С этой точки зрения имеются основания допускать, что в серной кислоте электрохимические процессы выражены более отчетливо, чем в соляной. Об этом можно судить по относительной скорости растворения железа и его окислов в соляной (табл. 5) и серной кислотах различной концентрации.
Таблица 5. Растворимость Fe, FeO и Fe2O3 в соляной кислоте
| Концентрация HCl, % | Растворимость, г/ч на 100 г вещества | Концентрация HCl, % | Растворимость г/ч на 100 г вещества | ||||
| Fe | Fe2O3 | FeO | Fe | Fe2O3 | FeO | ||
| 1 | 20,8 | 0,112 | 0,48 | 10 | 72 | — | — |
| 2 | 22,7 | 0,17 | 0,63 | 14 | 109,6 | — | — |
| 3 | 31,6 | 0,31 | 0,76 | 18 | 191,0 | 38,6 | 79,7 |
| 5 | 40,7 | 0,71 | 0,88 | 21 | 356,0 | 43,8 | 99 |
| 7 | 50,1 | 1,6 | 1.8 | ||||
Из данных табл. 5 видно, что растворимость металлического железа в соляной кислоте любой концентрации больше растворимости его окислов, растворимость закиси железа больше, чем растворимость окиси и с повышением концентрации соляной кислоты скорость растворения его окислов возрастает в большей степени, чем скорость растворения металлического железа.
В серной кислоте наблюдаются другие соотношения между скоростью травления металлического железа и его окислов. Так, в 10%-ной H2SO4 при 40° С из 100 г вещества растворителя 97,7 г Fe, 0,9 г Fe2O3 и 1,4 FeO, т. е. в 10%-ной H2SO4 металлического железа растворяется примерно в 70 раз больше, чем FeO, а в 10%-ной НCl — только в 10 раз. Такое соотношение говорит о неодинаковом электрохимическом механизме растворения окалины в соляной и серной кислотах. Можно допустить, что растворяющееся с большей скоростью в серной кислоте металлическое железо выделяет такое количество водорода, которое способствует взрыхлению окалины и механическому отделению ее от основы. Fe3O4 представляет собой полупроводник и в контакте с металлическим железом в разбавленной H2SO4 возникает э. д. с. порядка 0,8—1,0 В при плотности тока 2 мА/см2. Выделяющийся на магнетитовом катоде водород восстанавливает Fe3O4 до FeO и Fe, которые значительно легче растворяются в кислотах.
Fe2O3 — плохой проводник электрического тока и не может рассматриваться подобно магнетиту как катод л короткозамкнутом элементе. Больше того, этот окисел образует тонкую пленку, затрудняющую доступ кислоты к железу и, следовательно, тормозит работу гальванического элемента.
Электрохимический механизм растворения железа, покрытого окалиной, заключается в следующем. Окисление железа сопровождается изменением объема, в результате чего в окалине образуются трещины, через которые травитель находит доступ к наиболее легко растворяющемуся металлическому железу. Это подтверждается следующими данными: Железо и его окислы Fe FeO Fe2O3 Fe3O4 Плотность, г/см3 . . . 7,8 5,9 5,1 5,2 Таким образом мы можем заключить, что процесс растворения железа с окалиной основан на работе короткозамкнутого многоэлектродного элемента, в котором металлическое железо состоит из анодных и катодных участков, а его окислы являются катодами. Схему трехэлектродного элемента можно представить в следующем виде:
Fe (анодные участки) (катодные участки) окалина (катод)
Отслаивание окалины происходит в результате восстановления окислов железа до легкорастворяющейся в кислоте закиси железа, нарушения сцепления окислов с основным металлом после растворения закиси железа, а также из-за механического воздействия газообразного водорода, выделяющегося на поверхности стали. В результате соприкосновения электролита с металлом, находящимся под слоем окалины, выделяется газообразный водород. Следовательно, разряд ионов водорода на окалине невозможен. Он начинает выделяться только после проникновения электролита к основному металлу, причем главным образом в результате работы микропар. Концентрация и температура кислоты оказывают существенное влияние на скорость травления, однако отношении серной и соляной кислот они сказываются по-разному. В серной кислоте более сильное влияние оказывает повышение температуры; в соляной кислоте температура сказывается меньше, да и повышать ее из-за летучести кислоты выше 35—40° С нельзя. Так, например, скорость травления в 3%-ном растворе серной кислоты при 80° С в 10 раз больше, чем в 8%-ном растворе при 20° С. С повышением концентрации H2SO4 до 25%-ной скорость травления достигает максимума, после чего она уменьшается. При одинаковой концентрации скорость травления в соляной кислоте больше, чем в серной.
Кроме того, необходимо считаться с замедляющим действием солей железа в травильном растворе. Так, при повышении содержания FeSO4 от 50 до 200 г/л продолжительность травления в 5%-ной H2SO4 изменяется от 190 до 440 мин.
- Травление в фосфорной кислоте
- Травление нержавеющей стали
В чем опасность
Серная кислота — вещество, относящееся к классу повышенной опасности. Интоксикация может произойти не только при применении самой жидкости, но и при вдыхании ее паров, когда будет выделяться сернистый газ.
Токсическое воздействие вещества в любом виде распространяется, прежде всего, на дыхательную систему, слизистые оболочки и кожные покровы. В кислоте часто содержится мышьяк, что может приводить к усугублению интоксикации.
Отравление парами серной кислоты представляет не меньшую опасность, чем прямой контакт с жидкостью. Безопасная доза содержания вещества на открытом воздухе равна всего 0,3 мг на 1 квадратный метр.
При контакте с кожными покровами или слизистыми оболочками реагент приводит к образованию ожога, который тяжело поддается заживлению. При обширных повреждениях у пациента развивается ожоговая болезнь, способная, без своевременной медицинской помощи, привести к летальному исходу.
Смертельная для взрослого человека доза серной кислоты составляет всего 0,18 см на 1 литр!
Когда нужна помощь медиков
В случае интоксикации парами рассматриваемого вещества нужно обращаться к медикам абсолютно во всех случаях. Ведь подобное отравление очень опасное для здоровья, а иногда и для жизни человека.
После оказания первой помощи пострадавшему нужно как можно быстрее вызвать бригаду медиков.
Терапия в данном случае будет направлено на то, чтобы восстановить работу поврежденных органов, а также на поддержание жизнедеятельности.
Отравление пестицидами
Частые причины отравления
Столкнуться с чистой серной кислотой в обычной жизни довольно проблематично. В большинстве случаев отравление — следствие пренебрежения техникой безопасности при работе с раствором на производстве.
Возможно массовое отравление парами вещества, если из-за технических сбоев или неосторожности происходит его массивный выброс в атмосферу. Чтобы не допускать подобных выбросов, существуют специализированные службы, контролирующие работу производств, где используется серная кислота.